|
Les réactifs iodés
a) Le Lugol ou eau iodée
(notée I) est le réactif microscopique le plus utilisé pour
l'étude des Ascomycètes et en lichénologie (les lichens étant, sauf
exception, des ascolichens). Il est utilisé comme milieu de montage
plus ou moins universel mais colore principalement, plus ou moins
intensément, les structures apicales des asques et permet
l’observation du tholus. Cette réaction colorée est connue depuis
très longtemps et joue un rôle fondamental dans l’identification des familles, genres et espèces d'Ascomycètes lichénisés ou non.
Ce réactif
peu réfringent n’est pas éclaircissant mais donne des images à contours
bien nets. Il colore en brun acajou le glycogène ; cette coloration
tranche avec la teinte jaune brunâtre que prennent les parties non glycogéniques.
Le lugol met également en évidence l’amyloïdité (coloration bleue), l'hémiamyloïdité
ou dextrinoïdité de certaine structures situées au niveau de
l'apex des asques (coloration brun-rouge).
Attention : Si la structure a été préalablement traitée à la potasse
(KOH à 5-10 %) on obtient une coloration bleue avec le lugol, l’hémiamyloïdie
(brun-rouge) n’est pas mise en évidence.
Composition du Lugol
Iode
...............................................................
0,5 g
Iodure de potassium ........................................
1,5 g
Eau bidistillée
................................................ 100 mL
Préparation : dissoudre dans
20 mL d'eau bidistillée, 1,5 g d'iodure de potassium (IK) puis 0,5 g
d'iode (I) ; compléter avec de l’eau bidistillée jusqu’à 100 mL.
Cette
solution concentrée se conserve mal dans des petits en flacons (10 à
20 mL) et détruit plus ou moins rapidement les embouts en plastique
des compte-gouttes qui doivent être changés régulièrement). Il est
préférable de stocker le lugol en flacon de 100 mL.
Si
les flacons sont conservés en ambiance trop chaude (plus de 35°C
pendant plusieurs semaines, il y a décoloration de la solution qui
perd alors ses propriétés ; ce phénomène a été observé pendant la
canicule prolongée de l'été 2003).
Parfois la coloration est très forte et les détails ne sont pas
visibles. Il faut recommencer la préparation en diluant quelques
gouttes de lugol dans un verre de montre, dans une ou deux gouttes
d’eau. Cette solution diluée ne se conserve pas longtemps.
Autre
technique possible recommandée par plusieurs auteurs : Faire agir
successivement - KOH (dissociation partielle des cellules) - L’eau
pour éliminer KOH - Le lugol (ou lugol dilué) - L’eau pour diminuer
l’intensité de la coloration - Placer ensuite la lamelle, la potasse
ayant partiellement désagrégé les tissus il suffit d’appuyer
légèrement sur la lamelle pour dissocier les structures à observer.
Remarque 1 : La coloration du tholus dépend de la concentration de
la solution iodée mais également de l’intensité du prétraitement à
la potasse ; l’expérience et l’intuition du préparateur jouent un
rôle important dans le résultat final. L’étude des asques et du
tholus est particulièrement utile pour identifier avec certitude des
genres comme les Lecidea, Porpidia…
très semblables par leurs autres caractères.
Remarque 2 : Lorsque la coloration par le lugol ne semble pas suffisante, il
est possible d'utiliser, en particuliers pour les structures
apicales des asques, Le lugol double ou lugol concentré dans
lequel la concentration en iode est deux fois plus importante.
Composition du lugol double selon Baral
Iode
...............................................................
1 g
Iodure de potassium ........................................
3 g
Eau bidistillée
.............................................. 100 mL
Préparation : dissoudre dans
30 mL d'eau bidistillée, 3 g d'iodure de potassium (IK) puis 1 g
d'iode (I) ; compléter avec de l’eau bidistillée jusqu’à 100 mL.
Remarque 3 : Le lugol lactique se prépare de la même manière
que le lugol normal mais l'eau est remplacée par de l'acide
lactique. Il ne s'évapore pas aussi rapidement, présente un indice
de réfraction plus élevé et donne dans certains cas des réactions
plus fortes que le lugol normal.
Composition du lugol
lactique
Iode
.............................................................
0,5 g
Iodure de potassium ......................................
1,5 g
Acide lactique
.............................................. 100 mL
Préparation : dissoudre dans 20 mL d'acide lactique, 1,5 g d'iodure
de potassium (IK) puis 0,5 g d'iode (I) ; compléter avec de l'acide
lactique jusqu’à 100 mL.
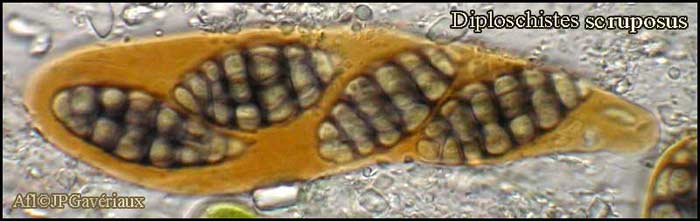
Asque
et spores - montage dans l'eau glycérinée après séjour dans le Lugol
|
![]()
![]()