|
a) L'eau de javel ou
hypochlorite de sodium (notée C) : on utilise la solution
concentrée du commerce (celle qui est dépourvue de colorants ou
d'aromatisants), placée dans un petit
flacon en verre fumé de quelques mL, facilement
transportable sur le terrain (possibilité de récupérer un flacon
ayant contenu un produit pharmaceutique). Le réactif est déposé à
l'aide de la spatule solidaire du bouchon sur le cortex, la médulle préalablement
dégagée avec une lame de rasoir, le bord de l’apothécie…
Instantanément ou dans les quelques secondes qui suivent une
coloration se développe (ou non).
Si on désire une réaction plus propre, on peut déposer le réactif à
l'aide d'une allumette effilée, d’un cure-dent en bois ou d’un
morceau de papier filtre préalablement imprégné de C.
On peut avoir une coloration jaune, orange, rouge, verte… parfois
fugace.
Les résultats de ces réactions colorées sont notés C+ suivi du nom
de la couleur obtenue (Ex : cortex C+ rouge si on obtient une
coloration rouge après avoir déposé C sur le cortex) ou C- lorsqu’il
n’y a pas de modification de la teinte.
Quelques exemples de réactions C+ :
Le thalle de Lecanora expallens devient orange (acide
thiophanique).
La médulle de Punctelia subrudecta devient rouge-carmin
(acide lécanorique).
Les squamules de Cladonia strepsilis donnent vert-bleu (strepsiline),
etc.
La solution doit être changée fréquemment. Elle se décompose
facilement et doit être renouvelée dès que l’odeur caractéristique
de javel n’est plus assez perceptible.
Il existe une solution stabilisée
(valide pendant 6-9 mois) mais le prix est beaucoup plus élevé.
|
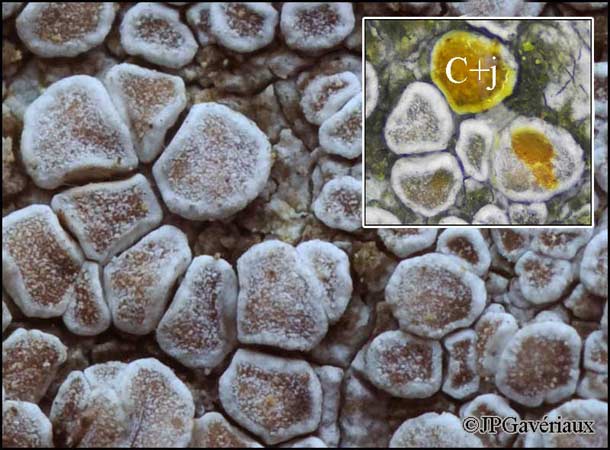
Les apothécies de Lecanora carpinea
sont C+ jaune |
|
![]()
![]()