|
Les
colorants rouges
a)
Le Rouge Congo est largement utilisé en microscopie
lichéno-mycologique comme colorant universel. Il colore en rose ± rougeâtre
les parois des hyphes fongiques. Utilisable surtout sur matériel frais
et exsiccata, ce colorant montre bien les hyphes, les cloisons, les
boucles et plus particulièrement la forme et la disposition des
paraphyses.
Le rouge Congo ammoniacal
On l'utilise obligatoirement quand on opère sur du
matériel sec (échantillons d'herbier). L'ammoniaque permet le
ramollissement et le regonflement des structures aussitôt colorées
par le Rouge Congo. Souvent la coloration est trop vive et il est
préférable, après coloration, de faire le montage dans de l'eau ou
mieux dans de l'eau glycérinée qui s'évapore moins rapidement. Les
structures colorées se détachent mieux du fond qui n'est plus rose
rougeâtre mais transparent.
Composition du rouge Congo ammoniacal
Rouge Congo ...................... 1 g
Ammoniaque ..................... 99 mL à 30%
Préparation : Sous une hotte aspirante, dans un erlenmeyer à col
étroit, mettre 1 g de rouge congo. Introduire rapidement 99 mL de la
solution commerciale d’ammoniaque (à 30% généralement) et placer
aussitôt un verre de montre sur l’erlenmeyer pour limiter
l’évaporation de l’ammoniac qui est un gaz extrêmement irritant.
Agiter avec l’agitateur magnétique et, éventuellement, chauffer pour
faciliter la dissolution du colorant (sans excès car l’ammoniaque
passe à l’état de gaz à partir de 35°C). Laisser refroidir puis
filtrer en plaçant un couvercle sur l’entonnoir (d'après Erb et
Matheis - Pilz Mikroskopie - 1983).
Remarque 1 : Ne pas passer son nez au-dessus du flacon !
Remarque 2 : Ne laisser pas le flacon ouvert inutilement ! Cela
évite l’odeur désagréable mais empêche aussi le contact avec le CO2
atmosphérique qui forme avec l’ammoniaque du carbonate d’ammonium
responsable de la cristallisation du colorant ; la solution devient
progressivement inefficace. Il est possible de prolonger son action
en ajoutant un peu d’ammoniaque dans le flacon mais lorsque la
concentration devient insuffisante, le Rouge Congo forme des dépôts
et devient inutilisable au bout de 2 à 3 années.
Le rouge Congo aqueux
Sur
matériel frais on utilise la solution aqueuse ; il est parfois
nécessaire de faire un prétraitement à la potasse (KOH à 3% ou même
10% en fonction de la cohésion des hyphes) sans oublier de laver
avant traitement au Congo aqueux.
Composition du rouge Congo aqueux (seulement 0,5 % d’ammoniaque)
Rouge Congo
........................................... 3 g
Eau bidistillée ........................................ 98
mL
Ammoniaque .......................................... 2 mL
à 25%
Préparation : Sous la hotte aspirante reliée à l'extérieur,
dissoudre les 3 g de Rouge Congo dans 98 mL d'eau bidistillée,
ajouter ensuite 2 mL d’ammoniaque (d'après Erb et Matheis - Pilz
Mikroskopie - 1983) afin de faciliter l’action du colorant.
Le rouge Congo SDS (Sodium Dodécyl Sulfate)
Une autre composition a été imaginée par M. Monod, qui
ne met pas d’ammoniaque mais ajoute 1g de Sodium Dodécyl Sulfate (SDS),
un agent tensio-actif anionique qui rend la solution plus
mouillante. Le SDS ne doit toutefois pas être utilisé en présence de
KOH (formation de précipités).
Composition du rouge Congo SDS (Sodium Dodécyl Sulfate)
Rouge Congo
................................................. 1 g
Eau bidistillée
.............................................. 99 mL
SDS
.............................................................
1 g
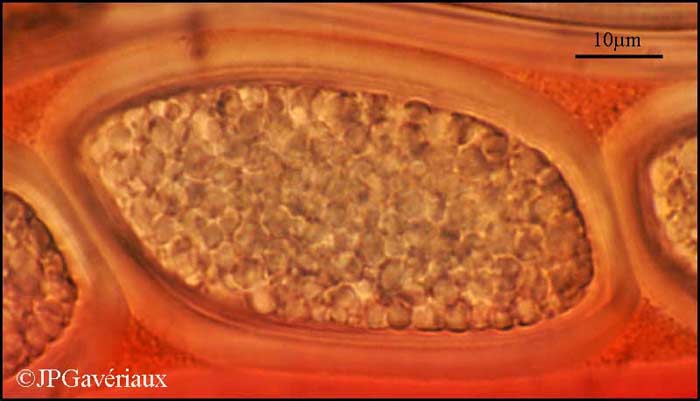
Spore de
Pertusaria leioplaca - montage dans le Rouge Congo SDS
|
![]()
![]()